Humanisierte Mausmodelle für die translationale Krebsforschung und Immuntherapie
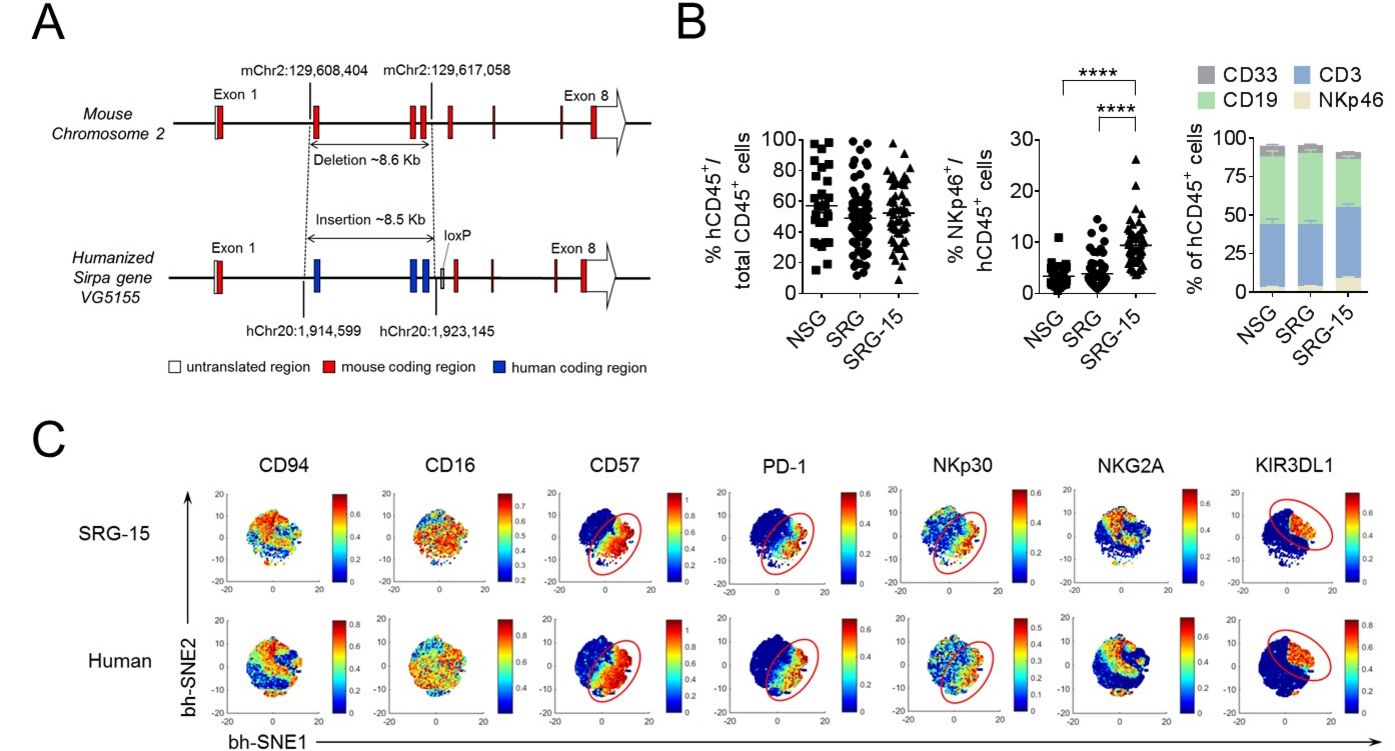
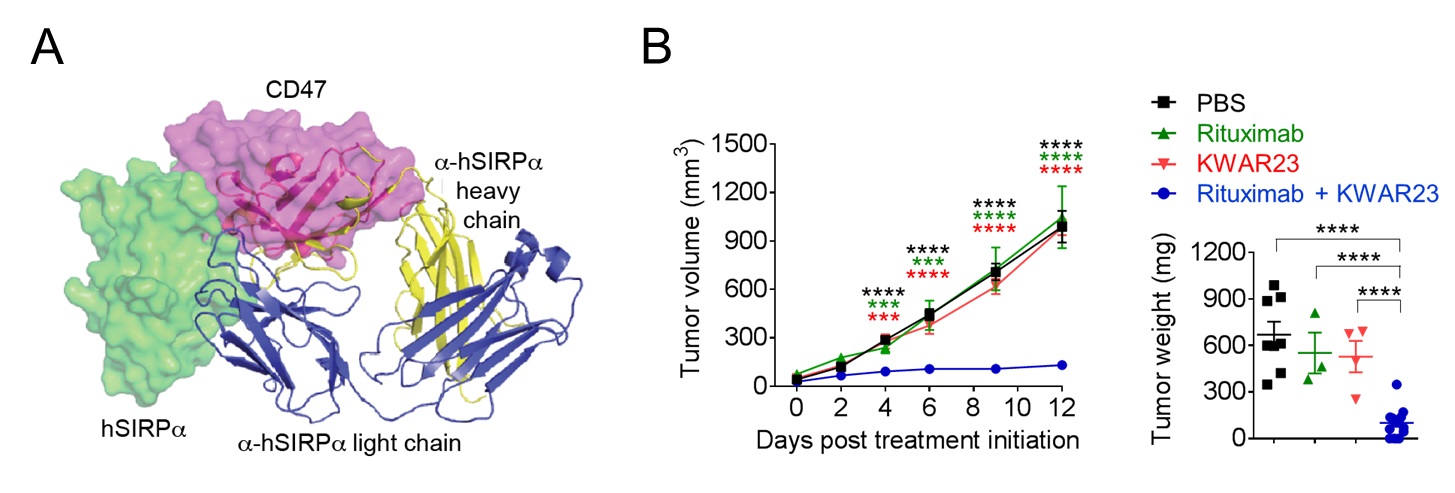
Humanisierte Mäuse (mit einem menschlichen Immunsystem rekonstituierte immundefiziente Mäuse) stellen ein vielversprechendes Werkzeug für die Präzisionsmedizin dar, da sie die Modellierung und Therapie menschlicher Krankheiten in vivo ermöglichen.
Wir verwenden ein humanisiertes Mausmodell, welches die Entwicklung eines humanen Immunsystems und das Wachstum von Patient:innen-Tumoren ermöglicht. Unser humanisiertes Mausmodell wird es uns ermöglichen zu untersuchen, wie die Tumormikroumgebung die menschlichen Anti-Tumor-Immunantworten in vivo reguliert, welche Mechanismen die Erschöpfung der Immunzellen, Tumorresistenz und Metastasierung fördern und welche Immuntherapie-Kombinationen bei der Eliminierung bestimmter Arten von Darmkrebs am erfolgreichsten sind.
Nichtkodierende RNA-Regulierung der adaptiven Immunität
Lange nichtkodierende RNAs (lncRNAs) spielen eine wichtige Rolle bei der Regulierung des Tumorwachstums und der Immunantwort. Durch die Verwendung von deep RNA-seq identifizierten wir neue lncRNAs, die während der adaptiven Immunität reguliert werden. Durch Genom-Engineering mittels CRISPR/Cas9 erzeugten wir Knockout-Mäuse, um zu verstehen, wie diese lncRNAs die adaptive Immunität regulieren.
Regulation der Immunzellentwicklung und der Anti-Tumor-Immunität durch Stromazellen
Stromazellen unterstützen hämatopoetische Stammzellen (HSC) und produzieren spezifische Differenzierungssignale für lymphoide Vorläuferzellen. Wir haben Reporter- und konditionale Knockout-Mäuse entwickelt, um die Rolle bestimmter Untergruppen von Stromazellen für die Entwicklung von Immunzellen und die Regulierung von Immunzellreaktionen zu untersuchen.