Therapie von Krebs im Spätstadium
Neben Immuntherapie sind Chemotherapie und Therapie mit kleinen, zielgerichteten Molekülen die beiden Hauptstrategien für die Therapie von Krebs im Spätstadium. In den letzten Jahrzehnten wurden viele neue Verbindungen entwickelt und damit die Wirksamkeit der Therapie verbessert.
Doch selbst beim Einsatz neuer, zielgerichteter Medikamente wird die Therapie oft durch starke Nebenwirkungen, Resistenzentwicklung und unzureichende Tumoraufnahme begrenzt. Folglich konzentriert sich unsere Forschung auf die Entwicklung neuer Strategien zur Überwindung dieser Probleme:
Untersuchung der Mechanismen, die der Empfindlichkeit/Resistenz von Krebszellen gegenüber Krebsmedikamenten zugrunde liegen
Beispiel: Thiosemicarbazone
Mit dem Ziel, die starke Eisenabhängigkeit von Krebszellen zu bekämpfen, wurden in den letzten Jahrzehnten verschiedene Chelatoren entwickelt. Am prominentesten unter diesen sind Thiosemicarbazone wie Triapine (derzeit in Phase III der klinischen Entwicklung).
Unsere Forschung zielt darauf ab, die Mechanismen zu verstehen, die der Resistenz gegen Thiosemicarbazone zugrunde liegen (Miklos et al. Cancer Letters 2015, Bormio Nunes & Hager et al. Journal of Medicinal Chemistry 2020).
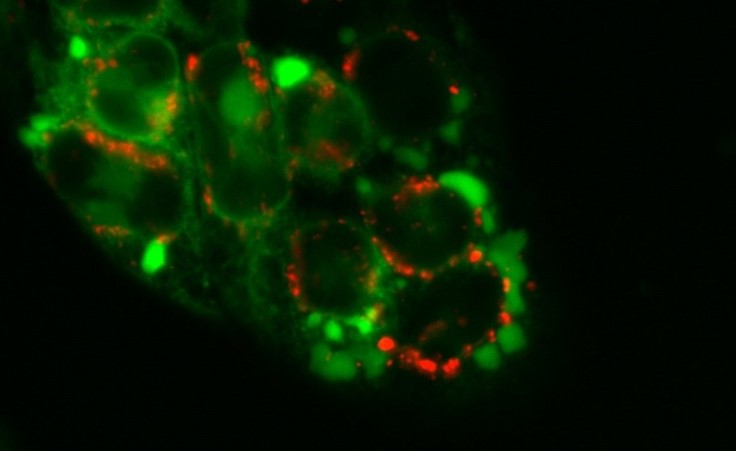
Darüber hinaus entwickeln wir (zusammen mit dem Team von Prof. C. Kowol) intensiv neue Derivate mit höherer Tumorselektivität und -aktivität (z.B. Kowol et al. J. Med. Chem 2016, Hager et al Antioxid Redox Signal. 2020) bzw. suchen wir Formulierungen, um die pharmakologischen Eigenschaften von Thiosemikarbazonen zu verbessern (Mathuber & Hager et al Dalton Trans 2021). Besonderes Interesse liegt hier in der Eigenschaft einiger Derivate, eine neue Form von programmiertem Zelltod (Paraptose) auszulösen, welche genutzt werden könnte, um die Resistenz gegen herkömmlichen Zelltod (Apoptose) zu umgehen (Abbildung 1, Hager et al Cell Death Dis. 2018).
Entwicklung neuer Targeting-Strategien zur Steigerung der Wirkstoffabgabe an das Tumorgewebe
In Kooperation mit dem Institut für Anorganische Chemie der Universität Wien wurde der „Research Cluster Translational Cancer Therapy Research“ unter der Leitung von Prof. B. K. Keppler und Prof. W. Berger etabliert, mit dem Ziel neuartige, besser verträgliche Therapeutika zu entwickeln (http://tctr.univie.ac.at/).
Unsere Bemühungen konzentrieren sich nicht nur auf die Entwicklung neuer Medikamente (z.B. KP1339, das sich derzeit in klinischen Phase II-Studien befindet), sondern insbesondere auch auf das Design von Prodrug-Konzepten zur Verbesserung bereits verfügbarer Therapeutika. Der Fokus liegt hier neben Rezeptor-Tyrosinkinase-Hemmern auf Platinverbindungen. Auch neue Nanocarrier werden erprobt.
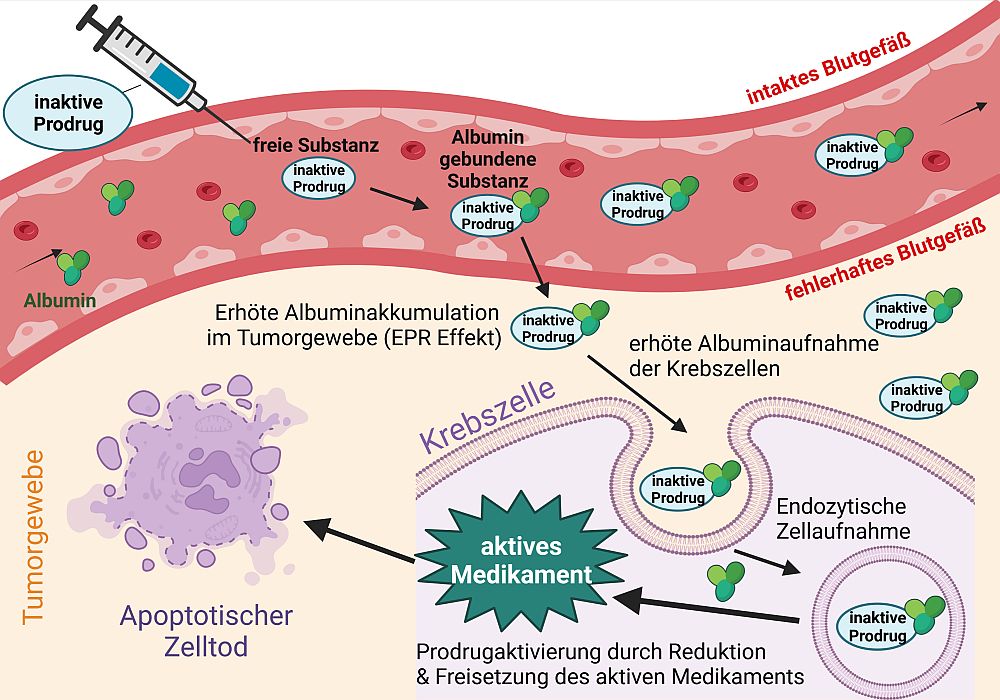
Zu unseren größten Errungenschaften (zusammen mit dem Team von Dr. C. Kowol) gehört neben dem ersten durch Hypoxie aktivierbaren EGFR-Inhibitor (Karnthaler-Benbakka et al. Angewandte Chemie 2014) die Entwicklung von albumin-bindenden Platin-Prodrugs (Abbildung 2, Mayr et al Chemical Science. 2017, Schüffl & Theiner et al Chemical Science 2021).
Verbesserung der Antikrebsaktivität durch intelligente Wirkstoffkombinationen
Um die Wirksamkeit der Krebstherapie zu verbessern, kann man Synergien in der Wirksamkeit zweier Medikamente ausnutzen. Über die Jahre haben wir mehrere solcher Synergien entdeckt und wissenschaftlich untersucht.
Ein Beispiel ist der Synergismus zwischen Arsen Trioxid (ATO), eines der ältesten bekannten Medikamente, welches erfolgreich gegen APL in Verwendung ist, und EGFR-Hemmern (Kryeziu et al. Mol Cancer Ther. 2013).
Im Fall von Platinverbindungen hat sich besonders die Kombination mit Immunstimulatoren als vielversprechend herausgestellt (Groza et al. Oncoimmunology 2018).
Sind Synergien entdeckt, können wir zusammen mit unseren Kooperationspartnern vom Institut für Anorganische Chemie intelligente Moleküle herstellen, welche beide Wirkstoffe gleichzeitig im bösartigen Gewebe freisetzen (z.B. Fronik & Poetsch Journal of Medicinal Chemistry 2021, Karmakar & Poetsch Inorganic Chemistry 2019).