PLASMAX: Weniger Verfälschung, mehr tumorrelevante Zellkulturen
Um Krebszellen unter physiologisch relevanteren Bedingungen zu untersuchen, hat meine Gruppe Plasmax™ entwickelt, ein chemisch definiertes Zellkulturmedium, das auf den im menschlichen Plasma vorhandenen Metabolitenwerten basiert (Vande Voorde et al. Science Adv. 2019).
Wir sind davon überzeugt, dass die Implementierung physiologischer Kulturbedingungen die Physiologie in vivo und damit die Biologie von Tumoren zuverlässiger vorhersagen wird. Wir haben kürzlich einen CRISPR-basierten Screen des gesamten Genoms durchgeführt, bei dem wir die Gen-Essentialität in dreifach negativen Brustkrebszellen (TNBC) verglichen haben, die in DMEM und in Plasmax™ kultiviert wurden (in Zusammenarbeit mit dem CRUK-Astra Zeneca Functional Genomic Centre, Cambridge, UK). Derzeit testen wir die Relevanz der identifizierten mediumspezifischen essentiellen Stoffwechselgene für TNBC.
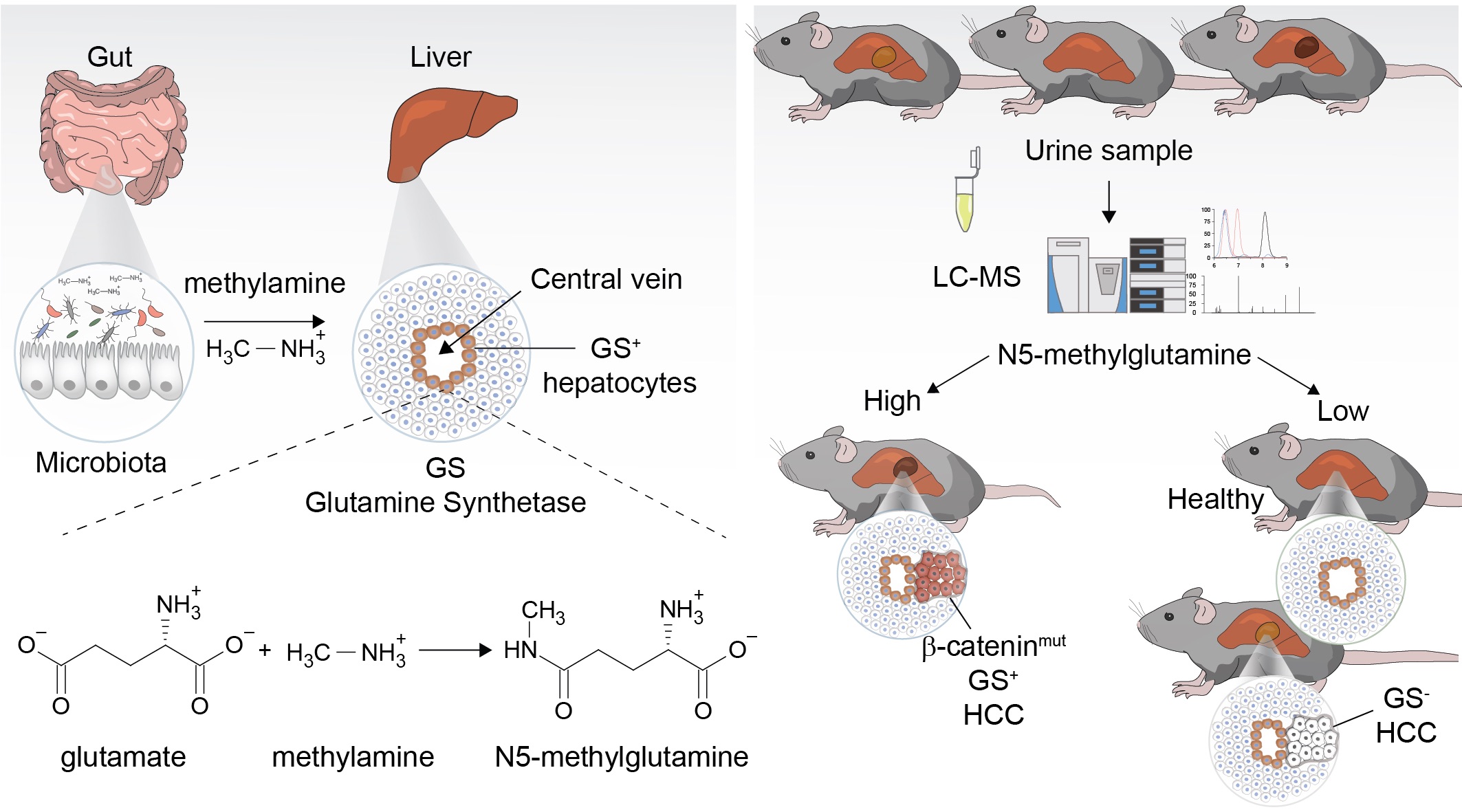
Die Rolle des Glutaminstoffwechsels in der Leberphysiologie und bei Krebs
Wir haben N5-Methylglutamin als neues Produkt der Glutaminsynthetase entdeckt und damit neue Verbindungen zum Stoffwechselnetzwerk zwischen Organen und Mikrobiom geschaffen. Darüber hinaus lässt sich anhand der N5-Methylglutaminwerte im Urin die HCC-Tumorlast in Mausmodellen genau vorhersagen, was das translationale Potenzial unserer Stoffwechselforschung veranschaulicht.(Villar et al. Nat Chem Biol 2022). Um die klinische Validität von N5-Methylglutamin als nicht-invasiver Stratifizierungsmarker zu beurteilen, werden wir Plasma- und Urinproben einer Kohorte von HCC-Patienten analysieren, die an einer speziellen klinischen Studie teilnehmen (klinische Leitung: Dr. Tom Bird, Universität Edinburgh). Ziel ist die Stratifizierung von Patienten mit durch Beta-Catenin bedingtem HCC, um eine personalisierte Behandlung zu ermöglichen. Dieses translationale Projekt wurde vom Sir Jules Thorn Trust UK finanziert.
Der Lipid- und Selenstoffwechsel steuert die Ferroptose bei dreifach negativem Brustkrebs (TNBC)
Ferroptose ist eine Art von Zelltod, der durch eisenabhängige Lipidperoxidation verursacht wird, der die antioxidative Wirkung von Selenoproteinen entgegenwirkt. Wir haben festgestellt, dass TNBC-Zellen, die in hoher Dichte in Kultur oder als Brusttumoren gezüchtet werden, einfach ungesättigte Fettsäuren (MUFAs) absondern, die Ferroptose verhindern. Zirkulierende TNBC-Zellen verringern jedoch die Expression von MUFA-produzierenden Enzymen und reagieren besonders empfindlich auf die Hemmung der Selenocysteinbiosynthese, die ihre Ausbreitung in die Lunge verhindert (Akermann et al. EMBO Mol Med 2024). Die Entwicklung von Verbindungen, die die Selenocysteinbiosynthese hemmen, bietet eine vielversprechende neue Strategie zur Bekämpfung der Metastasierung von TNBC, indem die Anfälligkeit zirkulierender Tumorzellen gegenüber Ferroptose ausgenutzt wird und so möglicherweise die Behandlungsergebnisse der Patienten bei diesem aggressiven Krebssubtyp verbessert werden.
Glioblastom-Stoffwechsel unter Steroiden
Dexamethason, ein entzündungshemmendes Steroidmedikament, wird häufig zur Behandlung von Patienten mit Hirntumoren eingesetzt. Wir haben festgestellt, dass Dexamethason einen direkten Einfluss auf den Stoffwechsel von Glioblastomen hat, indem es Methylgruppen über Nicotinamid-N-Methyltransferase (NNMT) in 1-Methylnicotinamid umleitet, wie die stabile Isotopenverfolgung von Nicotinamid bei Glioblastompatienten zeigt. Wir haben die tumorspezifische NNMT-Aktivität genutzt, um Hirntumore mit einem neuartigen Nicotinamid-PET-Tracer sichtbar zu machen, und eine Ernährungsintervention identifiziert, die in Kombination mit Dexamethason synergistische therapeutische Effekte hat.
Glutaminasehemmung beim Braf-mutierten Melanom
BRAF/MEK-Inhibitoren sind Erstlinienbehandlungen für BRAF-mutiertes Melanom, die den Tumorstoffwechsel neu verdrahten. Wir haben festgestellt, dass eine akute, aber nicht langfristige BRAF-Hemmung in vivo BRAF-mutiertes Melanom für CB839 sensibilisiert, einen klinisch sicheren Glutaminase-Inhibitor. Weitere Untersuchungen der durch MEK-Hemmung und Glutaminase-Blockade verursachten Stoffwechselschwachstellen werden zu rational konzipierten therapeutischen Kombinationen führen, die die Ergebnisse bei BRAF-mutiertem Melanom verbessern.