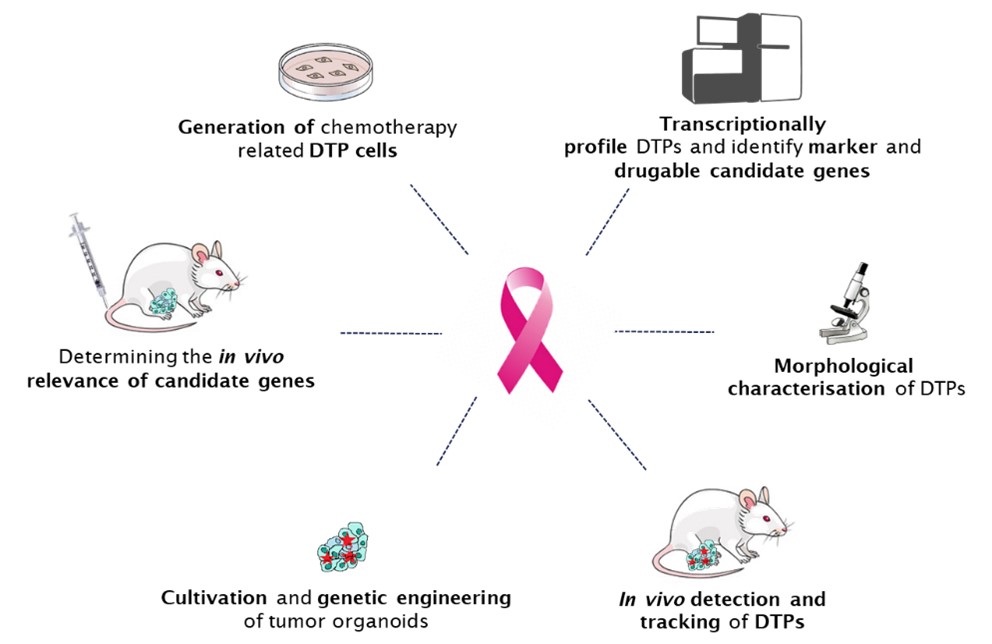
Allgemeines Konzept
Unsere Vorarbeiten haben die Reaktion von orthotop transplantierten tumortragenden Mäusen auf eine Reihe klinisch relevanter Chemotherapien charakterisiert. Während diese Therapien die Tumorgrößen signifikant verringern, sind sie nicht in der Lage, Tumorzellen auszurotten. Die wenigen überlebenden Tumorzellen führen nach Beendigung der Behandlung zu einem arzneimittelempfindlichen Tumorrezidiv.
Wir formulieren folgende Forschungsfragen:
- Was ist der Beitrag der phänotypischen Anpassung gegenüber der darwinistischen Selektion?
- Sind vor der Behandlung Zellen vorhanden, die eine DTP-Signatur zeigen?
- Werden unterschiedliche klinische Protokolle DTPs mit ähnlichen Signaturen induzieren?
- Was ist der relative Beitrag genetischer versus nicht-genetischer (epigenetischer, transkriptioneller Plastizität) Faktoren und der Wechselwirkungen mit der Mikroumgebung?
- Welche Beziehung besteht zwischen den Signalwegen, die DTPs unterstützen, und den Mechanismen, die der Therapieresistenz zugrunde liegen?
- Wie kann dieses Wissen in eine verbesserte Patient:innenversorgung umgesetzt werden?
Um diese herausfordernden Fragen zu beantworten, werden wir individuelle „Tumorgeschichten“ mit Einzelzell-Auflösung unter Verwendung von In-vitro-Zelllinien und Organoiden, die aus Krebsmodellen gentechnisch veränderter Mäuse (GEMMC) stammen, profilieren.
1. Ausrichtung auf medikamententolerante Persister: ein Paradigmenwechsel zur Bekämpfung von therapieresistentem Brustkrebs
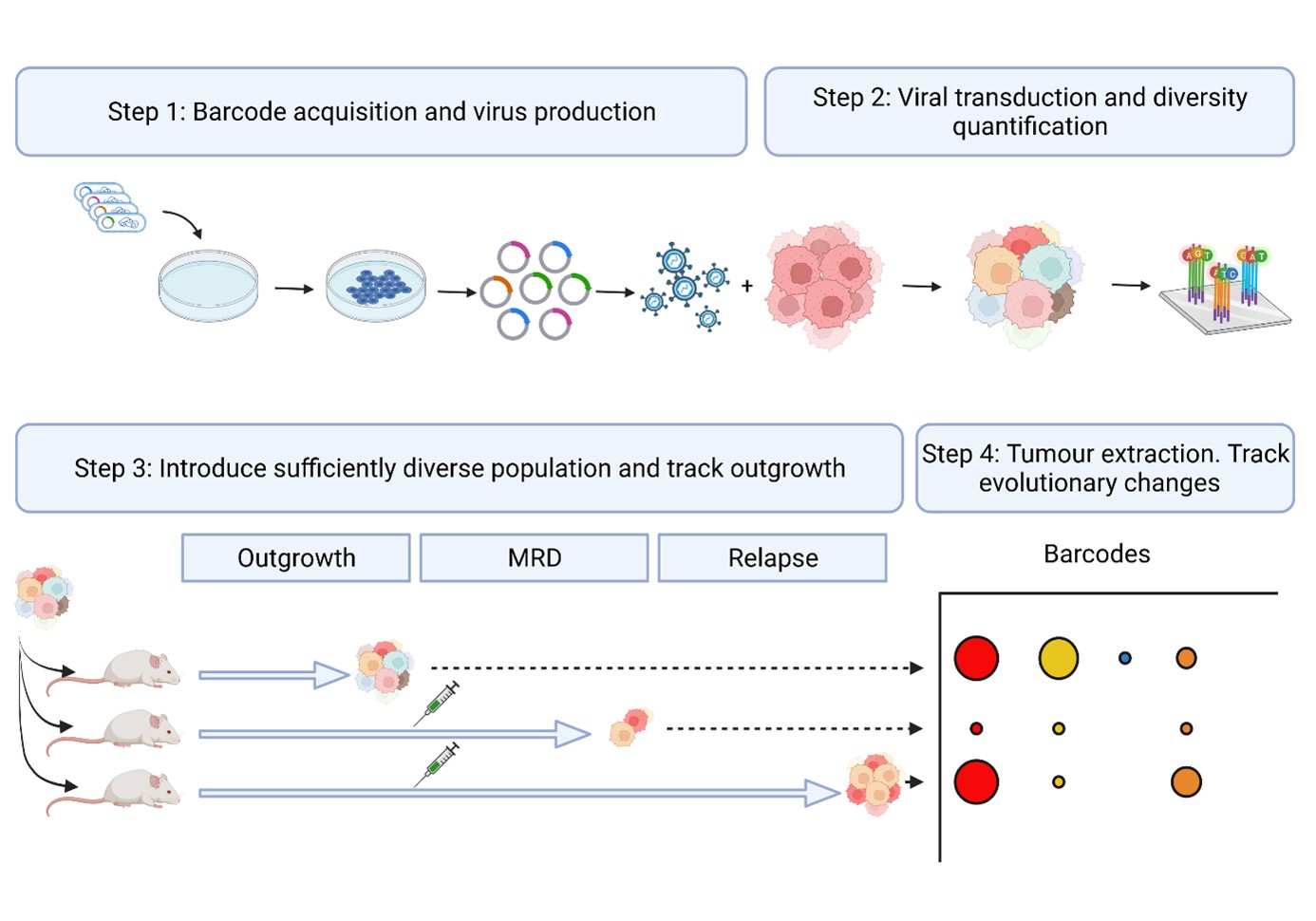
Wir werden barcodierte Mammatumore, die von Organoiden stammen, etablieren, behandeln und beproben, um (epi)genetische und transkriptionelle Veränderungen während der Behandlung zu verfolgen. Abgeglichene Proben, die behandlungsnaiven Zellen, DTPs und Rückfällen entsprechen, werden gesammelt. In Experimenten, die darauf abzielen, therapieresistente Tumore zu erhalten, wird die Chemotherapie fortgesetzt, bis die Behandlung uneffektiv wird.
2. Analyse von Signalwegen zur Aufrechterhaltung der Arzneimitteltoleranz unter Verwendung von Brustkrebsmodellen auf Organoidbasis
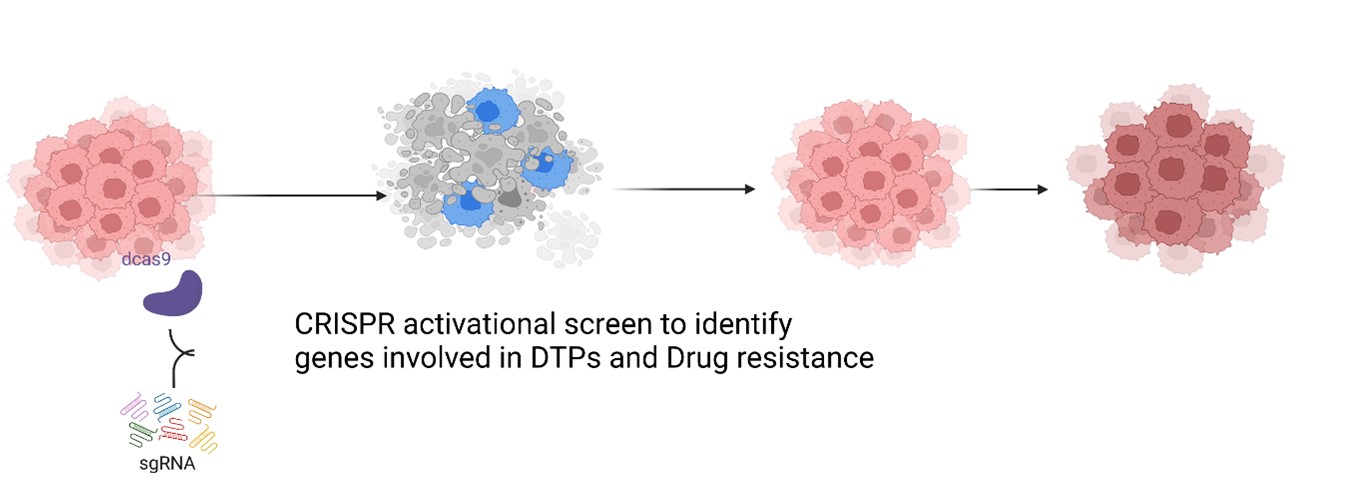
Das Hauptziel besteht darin, therapeutisch relevante Gene zu identifizieren, die am Überleben der DTP beteiligt sind. Wir werden einen genomweiten CRISPR-SAM-Aktivierungsscreen mit einem zuvor im Labor etablierten 2D-In-vitro-Repopulationsassay durchführen. Wir werden die Relevanz von Kandidatengenen anhand von 3D-Tumor-Organoid- und gentechnisch veränderten Mausmodellen (GEMM) validieren.
3. REAP: Aufdeckung arzneimitteltoleranter Persisterzellen bei Krebs mittels optischer Kohärenz und photoakustischer Tomographie
In REAP beabsichtigen wir, Bildgebungssysteme bereitzustellen, die in mehreren Maßstäben nützlich sind, um arzneimitteltolerante Persisterzellen in einer präklinischen Umgebung aufzudecken. Wir werden eine dreifach modale Zwei-Photonen-Laserscanning – optische Kohärenz – photoakustische Mikroskopie für In-vitro-Untersuchungen sowie eine dual modale optische Kohärenz – photoakustische Tomographie für In-vivo-Anwendungen entwickeln. Parallele Entwicklungen bei Kontrastmitteln auf der Grundlage von biofunktionalisierten Nanopartikeln, neuen Lasern, Detektortechnologie und Echtzeit-Datenverarbeitung, unterstützt durch Deep-Learning-basierte Analyse, werden zur Erkennung, Charakterisierung und schließlich zur Ausrottung von Persister-Zellen führen.
4. Identifizierung neuer Treibergene für Chemoresistenz
Das Hauptziel dieses Projekts ist die Verwendung von In-vitro- und In-vivo-Assays zur Identifizierung und Charakterisierung schwer fassbarer arzneimitteltoleranter Persisterzellen. Unter Verwendung eines etablierten In-vitro-Repopulationsassays zur Modellierung des Wiederauftretens von Krebs nach einer Chemotherapie in vitro werden wir behandlungsnaive, DTP- und „rezidivierte“ Zellen durch RNA-Sequenzierung profilieren.
5. Aufdeckung der Rolle der extrazellulären Matrix bei der Resistenz gegen die Behandlung mit EGFR-Inhibitoren bei dreifach negativem Brustkrebs
Unser Ziel ist es, die Rolle der extrazellulären Matrix (ECM) bei der Therapieresistenz aufzudecken, indem wir Mausmodelle, klinisch relevante Behandlungen und komplexe In-vitro-Modelle verwenden. Unsere Hoffnung ist, spezifische ECM-Komponenten zu identifizieren, die gezielt gehemmt werden können, um TNBC-Patient:innen für Therapie zu sensibilisieren.