Stationäre Zellen
Von besonderer Bedeutung sind replikationsunabhängige Mutationen, also Mutationen, die in stationären Zellen auftreten. Da sie zu einer versteckten Häufung von Schäden führen können, spielen sie eine entscheidende Rolle bei der Krebsentstehung und gewinnen im Alter an Bedeutung, wenn wir mit einer erhöhten genomischen Instabilität konfrontiert sind, z.B. NHEJ mit einer deutlich erhöhten Fehlerquote.
Durch die Untersuchung dieser Mechanismen am Modellorganismus S. cerevisiae erhoffen wir uns Erkenntnisse über die Zusammenhänge, die langfristig zum Verlust der Wachstumskontrolle und zur Instabilität des Genoms (typische Eigenschaften von Tumorzellen) führen können.
Oxidativer Stress
Reaktive Sauerstoffspezies (ROS) werden während des normalen Zellstoffwechsels erzeugt. Erhöhte ROS-Spiegel treten als Folge verschiedener Arten von Stress auf. ROS können essentielle zelluläre Makromoleküle (Lipide, Proteine, Nukleinsäuren) schädigen und stehen im Verdacht, eine Rolle bei der Entwicklung mehrerer menschlicher Krankheiten, Alterung und Krebs zu spielen.
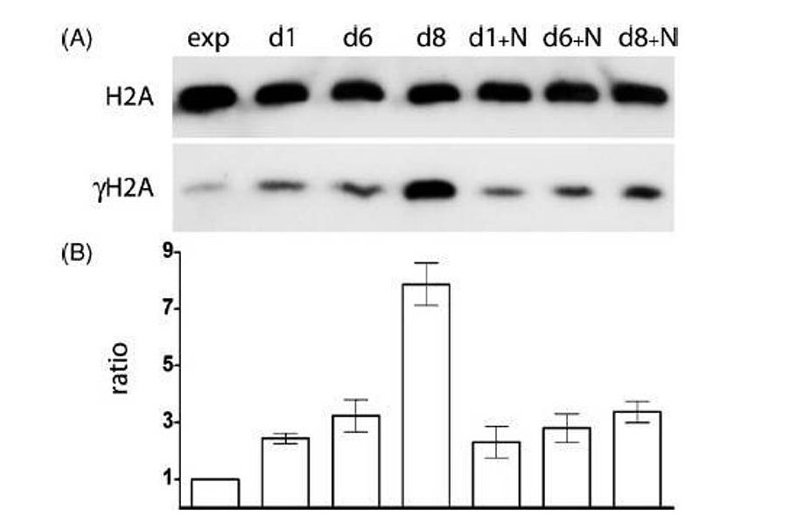
Die Mutagenität oxidativer DNA-Schäden in proliferierenden Zellen ist gut untersucht. So ist beispielsweise bekannt, dass die quantitativ wichtigste oxidative DNA-Schädigung – die Umwandlung von Guanin zu 8-Oxo-Guanin – letztendlich zu einer Transversionsmutation von G nach T führt (da bei der Replikation höchstwahrscheinlich ein dAMP gegenüber dem eingebaut wird 8-Oxoguanin). Es ist jedoch ziemlich unklar, auf welche Weise ROS Mutationen in ruhenden, nicht proliferierenden Zellen (wie es die Mehrheit der somatischen Zellen bei Erwachsenen darstellt) verursacht.
Unter Verwendung des Modellorganismus S. cerevisiae untersuchen wir, wie intrazelluläre ROS Mutationen in ruhenden Zellen erzeugen können, z.B. über fehleranfällige DNA-Reparaturmechanismen.
Reparatur von DNA-Doppelstrangbrüchen
DNA-Doppelstrangbrüche (DSBs) können durch ionisierende Strahlung, Sauerstoffradikale und verschiedene Chemikalien verursacht werden. Sie stellen eine ernsthafte Bedrohung für Zellen dar und sind eine potenzielle Ursache für Krebs.
Darüber hinaus ist es wahrscheinlich, dass die Akkumulation unreparierter DSBs einer der Gründe für den Alterungsprozess von Säugetierzellen ist. Die Reparatur von DSBs ist wesentlich für die Aufrechterhaltung der genomischen Integrität und das Überleben von Zellen.
Drei Hauptreparaturwege sind bekannt: homologe Rekombination (HR), nicht-homologe Endverbindung (NHEJ) und Einzelstrang-Annealing (SSA). Diese Wege untersuchen wir am Modellorganismus Saccharomyces cerevisiae. HR ist ein fehlerfreier Reparaturmechanismus, bei dem der Wiederaufbau nach einer bestehenden intakten Sequenz erfolgt, die sich typischerweise am Schwesterchromatid oder an einem homologen Chromosom befindet. SSA benötigt keine homologen Chromosomen, sondern benachbarte homologe Sequenzen auf beiden Seiten des DSB. Terminal präsentiert, werden sie verbunden und schließlich kovalent ligiert. Die Reparatur von DSBs über NHEJ erfolgt durch Ligation der losen Enden, unabhängig von einem Template.
Alle drei Wege sind am DSB in Säugerzellen beteiligt. Die Beteiligung der verschiedenen Wege ändert sich je nach Zellzykluszustand, Ploidie der Zellen und wahrscheinlich einigen anderen – noch unbekannten – Einflüssen.