Juliane Winkler, PhD
Forschungsschwerpunkt
Tumorheterogenität und Metastasierung
Die größte Herausforderung in der Onkologie bleibt die effektive Behandlung von Metastasen.
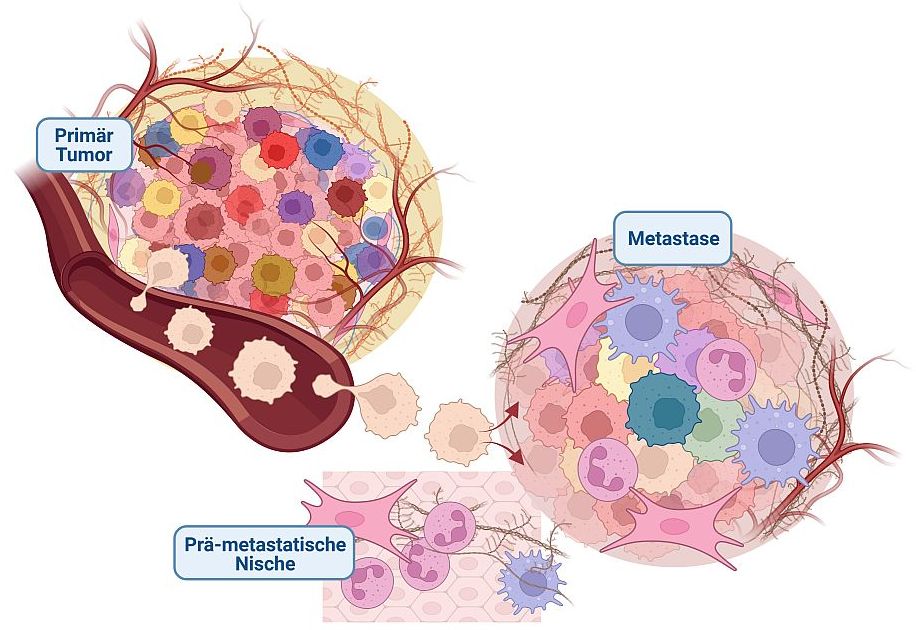
Die derzeitige Krebsbehandlung zielt auf die Bekämpfung des Primärtumors, hat aber meist wenig Wirkung auf metastatische Zellen. Dies ist ein erhebliches Problem, da Metastasen für die überwiegende Mehrheit der krebsbedingten Todesfälle verantwortlich sind. Während des mehrstufigen Prozesses der Metastasierung passen sich Tumorzellen an verschiedene Umgebungen an, die sich von dem Ursprungsort des Tumors unterscheiden. Allerdings ist unser Verständnis der Prozesse, die zu diesen Anpassungen führen, begrenzt. Darüber hinaus können phänotypische Veränderungen von metastatischen Zellen auch Resistenzen gegen Therapeutika verursachen, die nicht allein durch genotypische Veränderungen erklärt werden können.
Warum entwickeln also manche Patienten Metastasen und andere nicht? Tumore bestehen aus einzelnen Tumorzellen, die sowohl genetisch unterschiedliche Informationen (genetische intratumorale Heterogenität) als auch sehr unterschiedliche Phänotypen (phänotypische intratumorale Heterogenität) aufweisen können. Die einzelnen Tumorzellen interagieren auf einzigartige Weise mit ihrer Umgebung und mit einer Vielzahl von nicht bösartigen Stroma- und Immunzellen. Zusammengenommen beeinflussen all diese Faktoren die Fähigkeit von Tumoren zur Metastasierung.
Die Arbeitsgruppe für Tumorheterogenität und Metastasierung untersucht, wie die Tumorheterogenität das Metastasierungsverhalten beeinflusst, wie dabei einzelne Tumorzellen mit der Umgebung interagieren (Winkler et al. Nature Communications 2020) und insbesondere, wie das angeborene Immunsystem (prä-)metastatische Nischen in entfernten Organen etabliert.
Wir verwenden technologiegetriebene Ansätze der System-Onkologie, die zu aussagekräftigen Einblicken in die komplexe Biologie der Metastasierung führen. Wir haben MULTI-Seq (McGinnis et al. Nature Methods 2019) mitentwickelt, einen neuartigen Multiplexing-Ansatz für die Einzelzell-RNA-Sequenzierung (scRNA-Seq), der eine kostengünstige Erhöhung der Probenanzahl, die Reduzierung von Batch-Effekten, und eine Untersuchung von schwierigen Zellpopulationen ermöglicht.
Im Winkler Labor verwenden wir diese scRNA-Seq-Technologie zusammen mit anderen Einzelzell-Omics-Technologien und räumlichen Anwendungen, um zu verstehen wie sich Tumorheterogenität auswirkt auf:
- die Bildung und Progression von Metastasen
- die Tumor-Immunzell-Interaktion
- Therapieresistenz von Metastasen.
Ausgewählte Publikationen
Single-cell analysis of breast cancer metastasis reveals epithelial-mesenchymal plasticity signatures associated with poor outcomes
Winkler J#, Tan W, Diadhiou CMM, McGinnis CS, Abbasi A, Hasnain S, Durney S, Atamaniuc E, Superville D, Awni L, Lee JV, Hinrichs JH, Wagner PS, Singh N, Hein MY, Borja M, Detweiler A, Liu SY, Nanjaraj A, Sitarama V, Rugo HS, Neff N, Gartner ZJ, Pisco AO#, Goga A#, Darmanis S# & Werb Z.
# corresponding author
J. Clin. Invest. (2024) 134, e164227. doi: 10.1172/JCI164227
The temporal progression of lung immune remodeling during breast cancer metastasis
McGinnis CS, Miao Z, Superville D, Yao W, Goga A, Reticker-Flynn NE, Winkler J*#, Satpathy AT*#
# corresponding author * equal contribution
Cancer Cell (2024) 42(6), 1018-1031.e6. doi:10.1016/j.ccell.2024.05.004
The Tabula Sapiens: A multiple-organ, single-cell transcriptomic atlas of humans
Tabula Sapiens Consortium*
*Winkler J (Tabula Sapiens Consortium member)
Science. 2022 May 13;376(6594):eabl4896. doi: 10.1126/science.abl4896.
Bisphenol A replacement chemicals, BPF and BPS, induce pro-tumorigenic changes in human mammary gland organoid morphology and proteome
Winkler J#, Liu P, Phong K, Hinrichs JH, Ataii N, Williams K, Hadler-Olsen E, Samson S, Gartner ZJ, Fisher S#, Werb Z.
# corresponding author
Proc Natl Acad Sci U S A. 2022 Mar 15;119(11):e2115308119. doi: 10.1073/pnas.2115308119.
Concepts of Extracellular Matrix Remodelling in Tumour Progression and Metastasis
Winkler J#, Abisoye-Ogunniyan A, Metcalf KJ, Werb Z.
# corresponding author
Nat Commun 2020 Oct 9;11(1):5120. doi: 10.1038/s41467-020-18794-x.
MULTI-seq: sample multiplexing for single-cell RNA sequencing using lipid-tagged indices
McGinnis CS, Patterson DM, Winkler J, Conrad DN, Hein MY, Srivastava V, Hu JL, Murrow LM, Weissman JS, Werb Z, Gartner Z.
Nat Methods. 2019 Jul;16(7):619-626. doi: 10.1038/s41592-019-0433-8.
Alle Publikationen
Förderungen
| 01.09.2025 | |
| 25.07.2025 | |
| 06.05.2025 | |
| 25.07.2024 | Kurier TV: Krebsforschung: Wie KI bei Diagnose und Therapie helfen kann |
| 19.07.2024 | |
| 12.07.2024 | Dynamische Veränderungen im Immunsystem der Lunge bei der Metastasierung von Brustkrebs |
| 06.05.2024 | Universimed: Heureka! |
| 20.12.2023 | Juliane Winkler beim WWTF Life Sciences 2023 Call "Understanding Biology with AI/ML" erfolgreich |
| 18.08.2023 | Dr. Juliane Winkler ausgezeichnet mit der Fellinger Krebsforschungsförderung |
Zur Person
Dr. Juliane Winkler leitet das Labor für Tumorheterogenität und Metastasierung. Sie ist approbierte Apothekerin sowie Diplom-Pharmazeutin und promovierte an der Universität Heidelberg. Dr. Winkler erforschte in Zusammenarbeit mit dem Deutschen Krebsforschungszentrum (DKFZ), dem European Molecular Biology Lab (EMBL) und dem Institut für Pathologie des Universitätsklinikums Heidelberg, wie veränderte Signaltransportwege innerhalb der Krebszelle zu aggressivem Leberkrebs beitragen. Dr. Winkler arbeitete an der University of California San Francisco (UCSF) im Labor der renommierten Forscherin Zena Werb und Andrei Goga und forschte an Tumorheterogenität in metastasierendem Brustkrebs und entwickelte neue Methoden zur Untersuchung von Einzelzellen. Sie wurde für ihre Forschung und Mentoring mehrfach ausgezeichnet (z.B. EMBO long-term Fellow, AACR Scholar-in-Training Award, UCSF Dean’s Award for Excellence in Mentoring, honorable mention). Die Motivation für Ihre Forschung ist geprägt von der langjährigen Betreuung von Krebspatient:innen als weitergebildete Onkologieberaterin in der Apotheke und dem Wunsch die Behandlung von metastasierten Krebserkrankungen zu verbessern.